| |
Wasser mit der chemischen Formel H2O ist ein Stoff, der durch seine besonderen Eigenschaften (Wasserchemismus) auf der Erde in fester, flû¥ssiger und dampffûÑrmiger Phase sowohl in der HydrosphûÊre als auch in der LithosphûÊre und in der AtmosphûÊre existiert. Phasenû¥bergûÊnge erfolgen durch Kondensation, Verdunstung (Verdampfung), Gefrieren, Schmelzen, Sublimation oder Resublimation. In flû¥ssiger Form tritt das Wasser in den Meeren und den OberflûÊchengewûÊssern des Festlandes auf. Als Boden-, Grund- oder Tiefenwasser durchsetzt es die LithosphûÊre und als Wolkenwasser die AtmosphûÊre. In der festen Form bildet es die Eisschilde der Polargebiete, die Gletscher der Gebirge, die Eisdecken auf den Meeren, Seen und Flû¥ssen sowie die Schneedecken. Eis ist auch in der AtmosphûÊre und im Boden, zum Beispiel in den PermafrostbûÑden (Permafrost) der hûÑheren Breiten und Gebirgen, zu finden. Wasser ist ferner als Wasserdampf in der AtmosphûÊre und der LithosphûÊre enthalten.
Ohne Wasser ist auf der Erde kein Leben mûÑglich, die BiosphûÊre wû¥rde nicht existieren. Es ist Roh-, Bau- und Betriebsstoff fû¥r die Organismen (Wasser in Organismen). Neben Kohlenstoff und Sauerstoff ist es das wichtigste Element zur Bildung von Pflanzenbiomasse. Pflanze, Tier und Mensch bestehen vorwiegend aus Wasser. Es dient als Substanz zur Aufrechterhaltung der Zellstruktur und als Mittel zum Austausch von Stoffen fû¥r die KûÑrperfunktionen. Es ist Nahrungsmittel fû¥r Pflanzen, Tiere und Menschen. Als Trinkwasser ersetzt es das dem KûÑrper von der meist an Wasserdampf ungesûÊttigten AtmosphûÊre entzogene Wasser.
Wasser ist in vielen Stoffen gebunden und LûÑsungsmittel fû¥r viele Substanzen. So werden z.B. die NûÊhrstoffe im Boden gelûÑst und û¥ber SaugkrûÊfte im RûÑhrensystem der Pflanzen zu den Assimilationsorganen geleitet (Transpiration). Wasser ist Hygienemittel, es dient als Reinigungs-, Wasch- und Spû¥lmittel. Es verdû¥nnt oder beseitigt belastende oder giftige Schadstoffe und baut diese ab, sofern sich die Belastung in Grenzen hûÊlt (Abbau). Wasser ist Heilmittel und Erholungsmittel fû¥r den Menschen, z.B. fû¥r den Wasser- und Wintersport oder als Wasserkur. Es ist Lebensraum fû¥r aquatische Organismen und damit auch ein ûkosystem. Zudem formt es die ErdoberflûÊche, z.B. durch Erosion, und es strukturiert die BûÑden. Wasser ist Transportmittel oder Transportweg im Stoff-und Gû¥teraustausch. Es trûÊgt oder befûÑrdert Schiffe und nimmt gelûÑste oder suspendierte Stoffe im FliessgewûÊsser mit, wie z.B. das Abwasser.
Wasser ist auch TrûÊger von potentieller oder kinetischer Energie. Es wird zur Gewinnung von elektrischer Energie genutzt (Wasserkraftanlage). Es wird ferner zur ûbertragung von Energien und KrûÊften sowie zur Erzeugung hoher Drucke verwendet. Bei Hochwasser wirkt die Kraft des Wassers zerstûÑrend (Naturkatastrophen). Als Rohstoff fû¥r die Wirtschaft ist Wasser unentbehrlich. Es dient der Verarbeitung und Synthese von Stoffen, z.B. in Hû¥ttenwerken oder in der Chemieindustrie. Wasser ist ein Kû¥hlmittel in der Natur und in der Technik, z.B. bei thermischer Erzeugung von Energie und bei industriellen Produktionsprozessen. Bei Kû¥hlprozessen wird der OberflûÊche durch die Verdunstung WûÊrme entzogen. Wasser beinhaltet latente Energie, die bei PhasenûÊnderungen durch die Prozesse Verdunstung, Kondensation, Schmelzen, Gefrieren oder Sublimation umgesetzt wird. Es ist somit ein Regler des Energiehaushaltes der Erde und der Wettersysteme in der AtmosphûÊre. Der Wasserdampftransport sorgt fû¥r einen Wasserausgleich auf der Erde.
Im Vergleich zu anderen Stoffen hat das Kontinuum Wasser in mehrfacher Hinsicht anomale Eigenschaften. Dazu gehûÑren vor allem das Dichtemaximum bei 3,98ô¤C, hohe spezifische WûÊrme, hoher Siedepunkt, hohe Schmelz- und VerdampfungswûÊrme sowie grosse DielektrizitûÊtskonstante. Dies ist durch den Dipolcharakter des Wassers, das kleine Molvolumen und auf die Mischung von verschiedenen Wassermolekû¥laggregationen im natû¥rlichen Wasser zurû¥ckzufû¥hren. Man unterscheidet elektrische, mechanische, optische und thermische Eigenschaften. Alle diese Eigenschaften sind mehr oder weniger stark von der Temperatur und Wasserinhaltsstoffen, besonders vom Salzgehalt abhûÊngig.
Elektrische Eigenschaften Wasser verfû¥gt, bedingt durch die Molekû¥lstruktur, û¥ber Besonderheiten bezû¥glich der elektrischen LeitfûÊhigkeit fû¥r elektrische StrûÑme und Wellen, Eindringtiefe elektromagnetischer Wellen und der DielektrizitûÊtskonstante, die sowohl von der Temperatur als auch von den Wasserinhaltsstoffen, insbesondere vom Salzgehalt, beeinflusst werden. Der elektrische Widerstand R ist wegen des geringen Anteils an dissoziierten H+- und an OH--Ionen in reinem Wasser gross und die elektrische LeitfûÊhigkeit k=1/R gering. Letztere liegt bei reinem Wasser je nach Wassertemperatur zwischen 1,6ôñ10-6 und 20ôñ10-6 S/m. In verschmutztem Wasser, z.B. Regenwasser mit niedrigem pH-Wert, steigt die LeitfûÊhigkeit auf ein Vielfaches, z.B. auf 10-4 S/m an. Wasser ist durch eine abnorm hohe DielektrizitûÊtskonstante gekennzeichnet. Dies ist dadurch bedingt, dass die Wassermolekû¥le in einem elektrischen Feld versuchen, dieses zu neutralisieren. In einem elektrischen Feld wenden sie ihre negativ geladene Sauerstoffatom-Seite dem Plus-Pol (Anode) und ihre positiv geladene Wasserstoffatom-Seite dem Minus-Pol (Kathode) zu. Die absolute DielektrizitûÊtskonstante ö0, d.h. fû¥r Vakuum, hat den Wert 8,854ôñ10-12 C/(Nôñm2). Die dimensionslose relative DielektrizitûÊtszahl (PermittivitûÊtszahl) ör des Wassers mit der Temperatur 20ô¤C betrûÊgt 80 (Tab. 1).
Die Eindringtiefe elektromagnetischer Wellen in Wasser ist frequenzabhûÊngig und wird von der LeitfûÊhigkeit der Flû¥ssigkeit mitbestimmt. Die Halbwerttiefe von LûÊngstwellen (VLF, ELF, ULF) betrûÊgt in Frischwasser bei 50 Hz etwa 20 cm, bei 500 Hz 0,5 m, bei 5 kHz 2 m, bei 50 kHz 5 m und fû¥r Hochfrequenzwellen (UKW, KW) bei 500 kHz ca. 20 m. Die Eindringtiefe von GHz-Wellen, z.B. Radar, liegt bei û¥ber 100 m. In Meerwasser mit hohem Salzgehalt dringen die Wellen erst ab 5 kHz nennenswert ein. Aus der Rû¥ckstreuung von Millimeter- und Zentimeter-Wellen lassen sich die Wassergehalte von Schneedecken oder BûÑden bestimmen (Fernerkundung). Die StrahlungsdurchlûÊssigkeit fû¥r UV-Strahlung wird zur Wasserentkeimung ausgenutzt, wobei der Spektralbereich des UVC bei 250-200 nm benutzt wird.
Mechanische Eigenschaften Wasser hat sowohl im ruhenden als auch im bewegten Zustand besondere mechanische Eigenschaften, die durch OberflûÊchen- und innere KrûÊfte bestimmt sind. Diese werden durch die Temperatur (Tab. 2) und den Salzgehalt beeinflusst. Das spezifische Volumen v des Wassers verringert sich mit abnehmender Temperatur entsprechend der Abnahme der Molekularbewegung, bis sie bei der Temperatur 3,98 ô¤C mit dem Wert 1,000ôñ10ã3 m3/kg ihren kleinsten Wert erreicht hat. Dann aber wird der Einfluss der Wasserstoffbindung stûÊrker als die durch geringere Bewegung der Wassermolekû¥le bewirkte Zusammenziehung. Die Wassermolekû¥le beginnen sich entlang der Linien ihrer Wasserstoffbindungen zu ordnen. Dabei bleiben Lû¥cken oder ûffnungen zwischen diesen Linien frei. Das Wasser dehnt sich aus, bis es erstarrt und die Kristallstruktur (Eis) annimmt.
Die Dichte ü verhûÊlt sich invers zum spezifischen Volumen v: ü=v-1. Beim Gefrieren erfolgt ein Dichtesprung um 9% und fû¥hrt auf den Wert 0,9168ôñ103 kg/m3 bei 0ô¤C fû¥r reines, luftfreies Eis. Letzteres ist leichter als Wasser; es schwimmt auf diesem und taucht etwa bis zu 90% in das Wasser ein. Das Dichtemaximum bei 3,98ô¤C bewirkt, dass GewûÊsser erst dann zufrieren kûÑnnen, wenn das gesamte Wasser auf 3,98ô¤C abgekû¥hlt ist. Die Dichte des Wassers nimmt mit grûÑsser werdendem Salzgehalt zu. Dies ist fû¥r das Meerwasser und die Dynamik der Ozeane von besonderer Bedeutung. Wegen des Salzgehaltes gefriert Meerwasser erst unterhalb 0ô¤C, wodurch sich auch das Dichtemaximum verschiebt. Bei einem Salzgehalt von 2,47% stimmt die Temperatur des Dichtemaximums mit dem Gefrierpunkt von -1,322ô¤C û¥berein. Die strenge Wasserstoffbindung im Wassermolekû¥l und im Kontinuum Wasser bewirkt eine ungewûÑhnliche KohûÊsion des Wassers als Flû¥ssigkeit. Dies ûÊussert sich in der hohen OberflûÊchenspannung. Die molekularen BindungskrûÊfte verleihen dem Wasser eine ZûÊhigkeit, die bei dessen StrûÑmung zu innerer Reibung oder ViskositûÊt und zu Schubspannungen fû¥hren. Der Koeffizient der inneren Reibung öñ (dynamische ViskositûÊt) hat fû¥r Wasser bei 20ô¤C einen Zahlenwert von etwa 1 mPaôñs=10-3 Nôñs/m2.
Die relative VolumenûÊnderung des Wassers bei einer DruckerhûÑhung, die KompressibilitûÊt ö¤, ist ausserordentlich klein. Bezogen auf die DruckerhûÑhung um 1ôñ105 Pa=0,1ôñ106 N/m2 betrûÊgt die relative VolumenûÊnderung nur 10-9 hPa-1. Die Relaxationszeit ü, d.h. die Einstellzeit nach FormverûÊnderungen auf (1/e)=0,368 des Anfangszustandes, ist extrem kurz und sie liegt in der GrûÑssenordnung von 10-11 bis 10-13 Sekunden. Die Ausbreitungsgeschwindigkeit vs von Schallwellen im Wasser hûÊngt von der Dichte und der KompressibilitûÊt ab. Sie betrûÊgt bei reinem Wasser von 25ô¤C etwa 1500 m/s. Im Meerwasser mit 3,5% Salzgehalt laufen die Schallwellen langsamer, und zwar mit 1450 m/s. Die Schallgeschwindigkeit wird zur Tiefenlotung oder zur Messung der Fliessgeschwindigkeit genutzt (Durchflussmessung). Sie wûÊchst mit steigender Temperatur.
Optische Eigenschaften Hydrologisch bedeutsame optische Eigenschaften des Wassers sind die Strahlungsreflexion an der WasseroberflûÊche, die Lichtbrechung an der GrenzflûÊche Wasser/Luft, die Strahlungstransmission und die Strahlungsstreuung im Wasser. Diese Eigenschaften werden von Trû¥bstoffen im Wasser beeinflusst. Die Strahlungsreflexion R ist sowohl von der WellenlûÊnge als auch von der Einfallsrichtung der Strahlung abhûÊngig. Sie wird nach der Gleichung von Fresnel beschrieben:
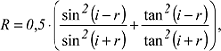 wobei i den Einfallswinkel der Strahlung (z.B. SonnenhûÑhe) und r den Brechungswinkel darstellen. WasseroberflûÊchen reflektieren im Lichtwellenbereich (ö£=0,4-0,7 ö¥m) etwa 5-7%. Sie absorbieren die Infrarotstrahlung (ö£=3 ö¥m) schon in dû¥nnen Wasserschichten nahezu vollstûÊndig. Die integrierte Reflexion û¥ber alle WellenlûÊngen, die Albedo, betrûÊgt fû¥r solare Strahlung (0,38-3 ö¥m) 6-12%, fû¥r die Lichtwellen (0,4-0,76 ö¥m) 5-15 % und fû¥r die terrestrische Strahlung (3-100 ö¥m) etwa 4,5%. wobei i den Einfallswinkel der Strahlung (z.B. SonnenhûÑhe) und r den Brechungswinkel darstellen. WasseroberflûÊchen reflektieren im Lichtwellenbereich (ö£=0,4-0,7 ö¥m) etwa 5-7%. Sie absorbieren die Infrarotstrahlung (ö£=3 ö¥m) schon in dû¥nnen Wasserschichten nahezu vollstûÊndig. Die integrierte Reflexion û¥ber alle WellenlûÊngen, die Albedo, betrûÊgt fû¥r solare Strahlung (0,38-3 ö¥m) 6-12%, fû¥r die Lichtwellen (0,4-0,76 ö¥m) 5-15 % und fû¥r die terrestrische Strahlung (3-100 ö¥m) etwa 4,5%.
Die Lichtbrechung an der Grenze Wasser/Luft ist durch eine Strahlkrû¥mmung zum optisch dichteren Medium hin, dem Wasser, gekennzeichnet. Sie wird durch den Refraktionsindex: n1,2=sinöÝ/sinöý=1,333 beschrieben, wobei n1,2 zur Luft=1,00029 und der Einfallswinkel mit der SonnenhûÑhe gleich gesetzt werden kann. Beim Erreichen des Grenzwinkels von öÝg=öýg=48,5ô¤ wird das Licht in das Wasser hineingebrochen. Unterlicht, das vom Wasser her zur OberflûÊche weist, unterliegt der Totalreflexion.
Die Brechzahl von Eis betrûÊgt 1,31. Wasser ist fû¥r die Strahlung durchlûÊssig. Mit zunehmender Tiefe wird die IntensitûÊt durch Absorption und Streuung gedûÊmpft. Die SchwûÊchung oder Extinktion kann durch das Lambert-Beersche Gesetz beschrieben werden. Dabei hûÊngt die StrahlungsintensitûÊt I im Wasser in der Tiefe z von der Strahlungsdichte Io an der WasseroberflûÊche und vom Extinktions- oder Absorptionskoeffizient a ab:
I=I0ôñe-aôñz .
Diese Gleichung gilt fû¥r homogene Medien sowohl fû¥r monochromatische als auch fû¥r die Gesamtstrahlung. Die DurchlûÊssigkeit D einer Wasserschicht d folgt aus:
D=(Id/Io)d.
Dabei stellt das VerhûÊltnis Id/Io den Transmissionsfaktor dar. Die Transmission T ergibt sich zu:
T=Io-I.
Der Absorptionskoeffizient a ist eine Funktion der optischen Eigenschaften des reinen Wassers und
seiner gelûÑsten kolloidalen und partikularen Inhaltsstoffe wie mineralische Schwebstoffe oder
Organismen, z.B. Algen. Die Lichtstreuung oder innere Reflexion im Wasser ist ebenfalls wellenlûÊngenabhûÊngig von Grad und
Art der Trû¥bung bestimmt. Die Trû¥bung bestimmt die Sichttiefe. Sie ist die gemeinsame Wirkung von
Streuung und Absorption und nimmt mit steigendem Feststoffgehalt ab. Der Trû¥bungsfaktor T gibt an,
wie viele Schichten reinen Wassers benûÑtigt werden, um die gleiche Extinktion wie bei verunreinigtem
Wasser zu erzeugen. Die Lichtstreuung erzeugt das Unterlicht, das bei flachen GewûÊssern auch
durch die Reflexion am GewûÊssergrund verstûÊrkt wird. Auf der Streuung beruht die Wasserfarbe.
Reines Wasser erscheint blau. Feinste Mineralstoffe erzeugen grû¥ne, grobes Mineral graue FarbtûÑne.
Ton und humose Stoffe geben dem Wasser gelbe, braune bis schwarze Farbe. Thermische Eigenschaften
Mit der Wasserstoffbindung der Wassermolekû¥le sind auch die besonderen thermischen
Eigenschaften von Wasser verbunden. Diesesind sowohl fû¥r Wasser in gasfûÑrmiger, flû¥ssiger und
fester Form temperatur- und druckabhûÊngig. Die AggregatzustûÊnde sind durch den Gefrier- oder
Schmelzpunkt und durch den Siede- oder Kondensationspunkt getrennt. Im Tripelpunkt bei 0,0098ô¤C
und 6,11 hPa Dampfdruck kûÑnnen alle Zustandsformen permanent nebeneinander bestehen. Die
Phasenû¥bergûÊnge durch Kondensation, Verdunstung, Gefrieren, Schmelzen, Sublimation und
Eisverdampfung sind mit EnergieumsûÊtzen verbunden. Dabei sind die Phasenû¥bergûÊnge Eis-Wasser-Eis von erheblich geringeren EnergieumsûÊtzen begleitet als bei den
AggregatsûÊnderungen Wasser-Dampf-Wasser oder Dampf-Eis-Dampf.
Die spezifische WûÊrme von Wasser cw ist im Vergleich zu anderen Flû¥ssigkeiten sehr hoch (Tab. 3).
Die AbhûÊngigkeit von der Temperatur T wird durch: cw=4,21-0,00177ôñT+0,0000127ôñT2 beschrieben. Sie wûÊchst auch mit steigendem Salzgehalt. Wasser ist auch durch eine grosse VolumenwûÊrmekapazitûÊt côñü gekennzeichnet. Der WûÊrmeinhalt, die Enthalpie ö, steigt mit der Temperatur. Sowohl die spezifische WûÊrme als auch die WûÊrmekapazitûÊt bewirken die bedeutende Rolle des Wassers im WûÊrmehaushalt der AtmosphûÊre und der Grenzschicht ErdoberflûÊche/AtmosphûÊre. Die spezifische WûÊrme der Luft betrûÊgt je nach Luftfeuchte nur 0,71-1,0ôñ103 J/(kgôñK) und die WûÊrmekapazitûÊt der Luft nur 1,3ôñJ/(môñK). Wasser ist bei gleicher Temperatur viel energiereicher.
Auch die molekulare WûÊrmeleitfûÊhigkeit ö£ ist von der Temperatur abhûÊngig. Im unbewegten oder laminar fliessenden Wasser betrûÊgt sie 0,6 W/(môñK) bei 20ô¤C. Die TemperaturleitfûÊhigkeit k des unbewegten Wassers:
k=ö£/(côñü) nimmt wegen der hohen WûÊrmekapazitûÊt côñü nur 1/100 der Werte der Luft an und zwar 0,15ôñ10-6 m2/s. Die spezifische WûÊrme von Eis ce ist nur etwa halb so gross wie jene von flû¥ssigem Wasser, und zwar betrûÊgt sie bei 0ô¤C 2,11ôñ103 J/(kgôñK). Die MolwûÊrme liegt bei 38,5 J/(molôñK). Entsprechend der geringen spezifischen WûÊrme sowie wegen des Dichtesprunges bei 0ô¤C ist die WûÊrmekapazitûÊt nur 47% jener von flû¥ssigem Wasser, und zwar bei ã20ô¤C von der GrûÑsse 1,80ôñ106 J/(m3ôñK) und bei 0ô¤C 1,93ôñ106 J/(m3ôñK). Die WûÊrmeleitfûÊhigkeit von Eis ist wesentlich hûÑher als die von Wasser. Bei 0ô¤C betrûÊgt sie 22,2 W/(môñK) und ist damit vier mal grûÑsser. Die WûÊrmeleitzahlen sind abhûÊngig von der Schneedichte. Fû¥r Neuschnee betrûÊgt die WûÊrmeleitzahl 0,08 W/(môñK) und fû¥r Altschnee ca. 1,5 W/(môñK). Neuschnee ist ein besonders guter WûÊrmeisolator. Die Temperaturleitzahl liegt nur bei etwa 0,5ôñ10-6 m2/s und ist etwa vier mal grûÑsser als jene von Wasser.
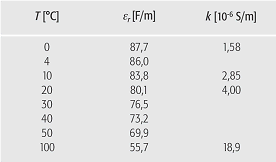 Wasser (Tab. 1): elektrische Eigenschaften von reinem Wasser als Funktion der Temperatur T (ör=relative DielektrizitûÊtskonstante, k=elektrische LeitfûÊhigkeit). Wasser (Tab. 1): elektrische Eigenschaften von reinem Wasser als Funktion der Temperatur T (ör=relative DielektrizitûÊtskonstante, k=elektrische LeitfûÊhigkeit).
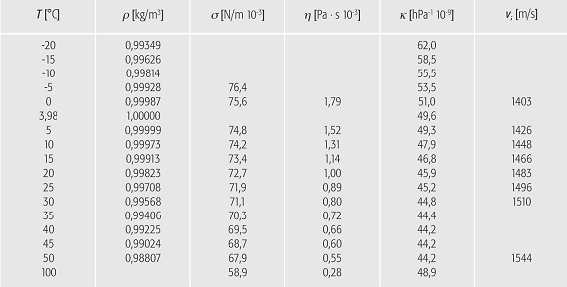 Wasser (Tab. 2): mechanische Eigenschaften des Wassers in AbhûÊngigkeit von der Temperatur T (ü=Dichte, ü=OberflûÊchenspannung, öñ=absolute (dynamische) ViskositûÊt, ö¤=KompressibilitûÊt, vs=Schallgeschwindigkeit bei 750 kHz in destilliertem Wasser). Wasser (Tab. 2): mechanische Eigenschaften des Wassers in AbhûÊngigkeit von der Temperatur T (ü=Dichte, ü=OberflûÊchenspannung, öñ=absolute (dynamische) ViskositûÊt, ö¤=KompressibilitûÊt, vs=Schallgeschwindigkeit bei 750 kHz in destilliertem Wasser).
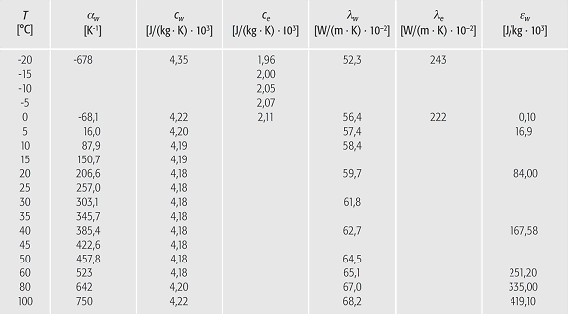 Wasser (Tab. 3): KenngrûÑssen zur Thermodynamik des Wassers in AbhûÊngigkeit von der Temperatur T (öÝ=thermische Ausdehnung, c=spezifische WûÊrme, ö£=WûÊrmeleitfûÊhigkeit, ö=Enthalpie; mit den Indizes w fû¥r Wasser und e fû¥r Eis). Wasser (Tab. 3): KenngrûÑssen zur Thermodynamik des Wassers in AbhûÊngigkeit von der Temperatur T (öÝ=thermische Ausdehnung, c=spezifische WûÊrme, ö£=WûÊrmeleitfûÊhigkeit, ö=Enthalpie; mit den Indizes w fû¥r Wasser und e fû¥r Eis). |
|