| |
Kräfte, die den Zusammenhalt der Kristallbausteine im Raumgitter bewirken und grossen Einfluss auf den Charakter der Minerale haben. Bei anorganischen Verbindungen liegt häufig Ionenbindung oder heteropolare Bindung vor. Die zwischen den Ionen wirksamen Kräfte sind um so grösser, je grösser die Ladungen und je kleiner die Ionenradien sind. Für viele physikalische Eigenschaften, z.B. für die Härte, ist diese Abhängigkeit unmittelbar gegeben. Ebenso für Schmelz-und Siedetemperaturen, die um so niedriger liegen, je grösser die Gitterabstände werden. Kristalle mit Ionengittern sind überwiegend durchsichtig, farblos oder farblos durchsichtig. Mehr als 80% der Minerale zeigen ionare Bindung, besonders häufig in den Mineralklassen der Halogenide, Hydroxide, Oxide, Nitrate, Carbonate, Borate und Sulfate. Bei den Phosphaten und Silicaten sind die Siliciumund Phosphatkomplexe heteropolar gebunden, während innerhalb der Komplexe selbst kovalente Bindung vorherrscht. Bei Kristallen mit Atomgittern ist die Bindung homöopolar oder kovalent. Vor allem diamantartige Verbindungen haben Gitter mit kovalenter Bindung. Im Gegensatz zu den Schmelzen von Ionenkristallen sind Schmelzen von Kristallen mit kovalenter Bindung elektrische Nichtleiter. Diamant ist einer der wenigen Kristalle, bei dem ausschliesslich nur eine, nämlich die homöopolare Bindung den Zusammenhalt des Gitters bewirkt. Da die Bahnen der Elektronen fixiert sind, resultiert hieraus eine hohe Gitterenergie, Nichtleitung der Elektrizität und eine hohe Härte. Dagegen ist der hexagonale Graphit ein guter Elektrizitätsleiter, er nimmt in seinem Bindungscharakter eine Zwischenstellung zwischen metallischer und Schichtmolekül-Bindung ein. Auch Zinn, Zinkblende, Wurzit und Manganblende zeigen überwiegend kovalente Bindung, obwohl letztere bereits einen Bindungsmischcharakter zwischen heteropolar und metallartig aufweisen. Solche Übergänge zwischen metallischer und ionarer Bindung sind bei den Mineralen relativ häufig. Bei der metallischen Bindung sind alle Valenzelektronen im Gitter frei beweglich. Daraus resultieren die typischen optischen Eigenschaften wie Opazität, hohes Reflektionsvermögen, äussere lichtelektrische Effekte und Leitfähigkeit. Typisch für die metallische Bindung sind Gitter mit dichtesten Kugelpackungen, wie sie bei Kupfer, Silber und Gold, Magnesium, Zink, Cadmium und Titan vorliegen. Da die Intensität der metallischen Bindung unterschiedlich ist, schwanken die übrigen Eigenschaften der Minerale, wie Härte, thermische Dilatation, Schmelzpunkt usw., beträchtlich. Als zwischenmolekulare oder van-der-Waalssche Bindung bezeichnet man die Kräfte, die durch den Dipolcharakter der Bindung hervorgerufen werden. Grosse Bedeutung hat die van-der-Waalssche Bindung beim H2O, wo sie in der zwischenmolekularen Wasserstoffbrückenbindung zum Ausdruck kommt, was die Hauptursache für das ungewöhnliche Verhalten von Eis und Wasser ist. Selbst im kristallisierten Zustand findet durch Öffnen und Schliessen der schwachen Brücken eine Verschiebung der H2O-Moleküle statt, woraus die gute Verformbarkeit des Eises, z.B. beim Schliessen der Gletscher, resultiert. Beim Schmelzen des Eises bleibt die Struktur der Wassermoleküle weitgehend erhalten, so dass flüssiges Wasser bis zu einer Temperatur von 4ºC eine grössere Dichte aufweist als das kristallisierte Eis. Eine Besonderheit ist die Hydroxyl-Bindung bei den Hydroxiden Hydrargillit, Diaspor und den Brauneisenmineralen. Fast immer liegen bei den Mineralen Mischungsbindungen vor (Abb.).
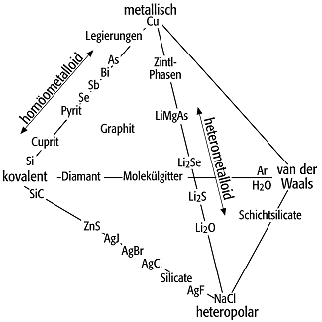 Bindung: Hauptbindungstypen der Minerale. Bindung: Hauptbindungstypen der Minerale. |
|