| |
Packung von Atomrümpfen, zwischen denen sich die Valenzelektronen quasi frei bewegen können (Elektronengas). Zur anschaulichen Deutung der metallischen Bindung kann man vom Orbitalmodell der Atome ausgehen und annehmen, dass sich die Atomorbitale dicht gepackter Atome soweit überlagern, dass sie alle zusammenhängen und dem Atomverband als Ganzes angehören. Nach dem Pauli-Prinzip spalten sich dabei die Energieniveaus der einzelnen Atomorbitale jeweils in eine Vielzahl energetisch sehr dicht benachbarte Zustände unter Bildung sog. Energiebänder auf. Wenn besetzte mit unbesetzten Bändern überlappen, dann können thermisch angeregte Elektronen sich praktisch frei zwischen den Atomrümpfen bewegen (Elektronengas), was zur elektrischen und thermischen Leitfähigkeit führt. Die Bindungskräfte durch das Elektronengas sind relativ schwach; Einkristalle der Metalle sind deshalb duktil und leicht verformbar. Metallische Festkörper sind normalerweise polykristallin; Versetzungen, Fehlstellen und Einlagerungen verleihen ihnen eine erhöhte Festigkeit, die für ihre Anwendung als Werkstoff wichtig ist. Die metallische Bindung ist ungerichtet und für alle Atome attraktiv. Es gilt das Prinzip der maximalen Koordination und dichtesten Packung. Weder gibt es Beschränkungen durch Elektroneutralität (wie bei Ionenkristallen), noch durch Bildung gerichteter Bindungen (wie bei kovalenten Verbindungen). Metallische Elemente sind deshalb vielfältig zu Legierungen mischbar. Die stöchiometrische Zusammensetzung intermetallischer Phasen besitzt gewöhnlich einen breiten Stabilitätsbereich (Abb.).
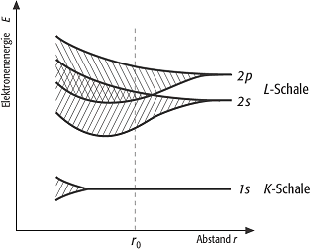 metallische Bindung: schematische Darstellung der Aufspaltung der atomaren Energieniveaus bei Annäherung einer grossen Anzahl gleicher Atome aus der ersten Achterreihe des Periodensystems. Der Abstand r0 charakterisiert den Gleichgewichtsabstand der Atome im Metallverband. Die Überlappung des besetzten 2s-Bandes mit dem leeren 2p-Band verleiht den Elementen Be und Al elektrische Leitfähigkeit. metallische Bindung: schematische Darstellung der Aufspaltung der atomaren Energieniveaus bei Annäherung einer grossen Anzahl gleicher Atome aus der ersten Achterreihe des Periodensystems. Der Abstand r0 charakterisiert den Gleichgewichtsabstand der Atome im Metallverband. Die Überlappung des besetzten 2s-Bandes mit dem leeren 2p-Band verleiht den Elementen Be und Al elektrische Leitfähigkeit. |
|