| |
Isotopentrennung, Änderung der Isotopenverhältnisse im Verlauf physikalischer und chemischer Reaktionen. Die verschiedenen Isotope eines Elements unterscheiden sich in ihrer Neutronenanzahl im Atomkern und damit (abhängig von der Gesamtmasse der Atome) mehr oder weniger deutlich in ihrer Masse . Bei bestimmten physikalisch-chemischen Prozessen wirken sich diese, wenn auch z.T. sehr geringen Massenunterschiede aus, und es zeigt sich ein Isotopieeffekt, d.h. die Isotope reagieren unterschiedlich.
Hängt dieser Effekt mit der Massenabhängigkeit des Bindungswillens der Isotope zusammen, spricht man von einem Gleichgewichts-Isotopieeffekt, der dazu führt, dass leichtere und schwerere Isotope im Gleichgewichtszustand in unterschiedlichen Verbindungen in verschiedener Häufigkeit vorliegen. Von einem kinetischen Isotopieeffekt spricht man, wenn die Geschwindigkeit einer chemischen Reaktion durch die atomare Masse einer beteiligten Spezies beeinflusst wird. Einige Prozesse lassen sich beiden Gruppen oder auch einer weiteren zuordnen, zu der auch bestimmte physikalisch-chemische Prozesse wie Verdampfung, Kondensation oder Diffusion zählen.
Das Ausmass von Isotopieeffekten wird in erster Linie von der relativen Massendifferenz der Isotope und im geringeren Mass auch von der Komplexität der Elementchemie bestimmt. Isotopieeffekte und daraus folgende Isotopenfraktionierungen führen deshalb bei Elementen mit relativ niedriger Masse (ca. <40 u) zu besonders deutlichen Isotopenverschiebungen. Ob ein Isotopieeffekt allerdings überhaupt zu einer Isotopenfraktionierung führt und welches Ausmass diese hat, hängt von verschiedenen Faktoren ab. Von Bedeutung ist insbesondere, ob der betreffende Prozess in einem geschlossenen oder offenen System stattfindet, ob Reaktionsprodukte aus dem System entzogen werden und wie vollständig der Prozess verläuft. So führt ein Isotopieeffekt, gleich welcher Grössenordnung, nicht zu einer Isotopenfraktionierung, wenn die Reaktion, bei welcher er auftritt, in einem geschlossenen System und quantitativ abläuft. Die Isotopenfraktionierung wird durch den Quotienten α definiert: α =RA/RB, wobei RA das Verhältnis von schweren zu leichten Isotopen in der
Phase A ist und RB das Verhältnis von schweren zu leichten Isotopen in der Phase B. Für Isotope eines Elements, deren relative Häufigkeiten aufgrund von Isotopieeffekten variieren, hat
sich die Bezeichnung stabile Isotope eingebürgert, um sie von radioaktiven Nukliden und radiogenen
Nukliden, also solchen, welche durch radioaktiven Zerfall entstanden sind, abzugrenzen. Die
wichtigsten Isotopenpaare, welche in der Natur aufgrund von Isotopieeffekten eine deutliche Isotopenfraktionierung zeigen, sind: 2H/1H, 7Li/6Li, 11B/10B, 13C/12C, 15N/14N, 18O/16O, 26Mg/24Mg,
30Si/28Si, 34S/32S und 44Ca/42Ca (2H/1H, 16O/18O, 12C/13C 32S/34S). Da die Isotopenfraktionierungen
dieser Elemente während des Durchlaufens spezifischer physikalisch-chemischer Prozesse
entstanden sind, geben die gefundenen Isotopenverhältnisse im Umkehrschluss Auskunft über eben
diese Prozesse. Sie sind deshalb Indikatoren für die Herkunft und die Geschichte des Elementes und
damit des untersuchten Minerals, Gesteins oder Wasserkörpers. Ein besonderer Vorteil ist hierbei,
dass einige der verwendeten Elemente Hauptgemengteile in üblichen geologischen Materialien sind.
Da durch Isotopieeffekte erzeugte Isotopenverschiebungen meist sehr klein sind, arbeitet man in der
Praxis nicht mit absoluten Isotopenverhältnissen, sondern gibt einen Delta-Wert an, welcher die relative Abweichung eines gemessenen Isotopenverhältnisses von dem eines Standards in der
Einheit Promille [‰] angibt.
Isotopenfraktionierung ist z.B. im natürlichen Wasserkreislauf messtechnisch nachweisbar vorhanden. Beim Verdunstungsprozess reichern sich die schweren Isotope im Wasser an, während sich bei der
Kondensation die schweren Isotope abreichern. Beim Gefriervorgang findet eine Abreicherung der
schweren Isotope in der flüssigen Phase statt. Bei Phasenumwandlungen nimmt die
Isotopenfraktionierung unter sonst gleichen Bedingungen bei Temperaturabnahme zu. Durch thermodynamische Vorgänge bei der Phasenänderung wird das Verhältnis des 2H-Gehaltes zum
18O-Gehalt beeinflusst. Bei wachsender Verdunstungshöhe wird 18O verhältnismässig stärker
angereichert als 2H. Unter besonderen Bedingungen kann eine Verschiebung dieses Verhältnisses auch durch einen Isotopenaustausch erfolgen (z.B. mit dem Grundwasserleiter). Durch die natürliche
Isotopentrennung findet im Meerwasser eine Anreicherung schwerer Wasserisotope statt. Der aus
den Meeren durch Verdunstung aufsteigende Wasserdampf hat einen geringeren Gehalt an
schweren Isotopen als das Oberflächenwasser. Durch das ständige Ausregnen schwerer Isotope bei
der Kondensation zu Niederschlagswasser verringert sich der Gehalt an schweren Isotopen mit
wachsendem Abstand von der Küste (Kontinentaleffekt). Daneben tritt mit zunehmender
Niederschlagshöhe eine Abreicherung schwerer Isotope ein (Mengeneffekt). Gleichzeitig nimmt der
Gehalt schwerer Isotope im Niederschlag beim Aufsteigen feuchter Luftmassen bei orographischen
Erhebungen ab (Höheneffekt). Dazu trägt die Temperaturabhängkeit der Isotopenfraktionierung bei,
da die mit der Höhe abnehmende Kondensationstemperatur eine Abreicherung der schweren Isotope
in den Niederschlägen bewirkt. Die Temperaturabhängigkeit der Isotopenfraktionierung und des
Luftfeuchtegehaltes hat ferner zur Folge, dass in den Niederschlägen ein jahreszeitlicher Gang des
Isotopengehaltes (Jahreszeiteneffekt) und eine Abreicherung der schweren Isotope mit zunehmender
geographischen Breite bzw. mit abnehmender Jahresmitteltemperatur festzustellen ist. In Gebieten mit niedriger Luftfeuchte (semiaride und aride Gebiete) tritt eine Anreicherung von
schweren Isotopen durch die beim Fallen der Regentropfen gleichzeitig stattfindende Verdunstung
auf. Aus Niederschlag gebildetes Oberflächenwasser oder oberflächennahes Wasser hat zunächst
die gleichen Gehalte an schweren Isotopen wie das Niederschlagswasser. Erst wenn
Oberflächenwasser dem Verdunstungsprozess ausgesetzt ist, findet eine Anreicherung statt. Auf dem
Weg zum Grundwasser und im Grundwasserkörper findet durch Isotopentausch eine weitere Abreicherung an schweren Isotopen statt. Als internationalen Standard Rs für das Isotopenverhältnis gilt das Verhältnis von 2H/1H und 18O/16O der Ozeane (Standard Mean Ocean Water=SMOW). Als Mass für die Abweichung einer Probe Rp vom Standard dient die Beziehung:
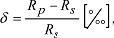 die separat für jedes einzelne Isotopenverhältnis bestimmt wird. die separat für jedes einzelne Isotopenverhältnis bestimmt wird. |
|