| |
Stabilitätsdiagramm, Zustandsdiagramm, p-T-Diagramm, Darstellung der Stabilitätsbereiche der Minerale in Abhängigkeit von den Zustandsvariablen. Die in einem System (Einstoffsysteme, binäre Systeme, ternäre Systeme) mit definierten substantiellen und physikalisch-chemischen Bedingungen ablaufenden Reaktionen sollten möglichst ein Gleichgewicht erreichen, was jedoch in der Natur selten der Fall ist. Hierdurch treten oft Widersprüche in den Aussagen experimenteller Untersuchungen und geologischer Beobachtungen auf. Für die Aufstellung von Phasendiagrammen sind physikalisch-chemische Gesetzmässigkeiten Voraussetzung, insbesondere des Massenwirkungsgesetzes, des Le Chatelierschen Prinzips des kleinsten Zwangs und der Gibbsschen Phasenregel (Zustandsdiagramm, Phasenbeziehungen).
Das Vorliegen von Wasser in seinen drei Aggregatzuständen Eis, Wasser und Wasserdampf wird in der Abb. 1 in Abhängigkeit von Druck und Temperatur dargestellt. Der invariante Tripelpunkt, an dem die drei Aggregatzustände gemeinsam vorliegen, liegt bei einer Temperatur von 273,1599 K (0,0099ºC) und einem Druck von 610,48 Pa (0,0061 bar); Eis hat eine zugehörige Dichte von 0,9168 g/cm3, Wasser von 0,9999 g/cm3. Der Taupunkt des Wasserdampfes (=Siedepunkt des Wassers),
d.h. die Temperatur, bei der ein Sättigungsdampfdruck von 1,013·105 Pa (1,013 bar) vorliegt, beträgt 373,12 K (ca. 100ºC). Die Dampfdruckkurve des Wassers endet am kritische Punkt bei einer Temperatur von 647,10 K (ca. 374ºC) und einem Druck von 2,2064·107 Pa=ca. 221 bar (kritische Dichte 0,322 g/cm). Das kubisch kristallisierende Eis-Ic kann bereits unterhalb einer Temperatur von 193,15 K metastabil vorliegen, stabil ist es erst unterhalb von 153,15 K. Oberhalb von 193,15 K geht es irreversibel in das hexagonale Eis-I über. Für die Modifikation Eis-II wurde eine kubische Struktur und für Eis-III eine tetragonale bestimmt. Nur die beiden Modifikationen Eis-I und Eis-Ic haben eine geringere Dichte als Wasser. In Abhängigkeit von Druck und Temperatur kann das Feld Eis in weitere Modifikationen unterteilt werden.
Die Koexistenz von Eis und Gas wird durch die Zustandsgleichung:
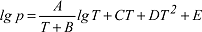 mit p in mmHg, T in K, A=-2445,5646, B=8,2312, C=-1677,006·10-5, D=120514·10-10 und E=-6,757169 beschrieben. Gleichermassen kann die Koexistenz von Flüssigkeit und Gas mit: mit p in mmHg, T in K, A=-2445,5646, B=8,2312, C=-1677,006·10-5, D=120514·10-10 und E=-6,757169 beschrieben. Gleichermassen kann die Koexistenz von Flüssigkeit und Gas mit:
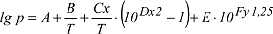 mit T in K, x=T2-293.700, y=374,11-T, A=5,4266514, B=-2005,1, C=1,3869·10-4; D=1,1965·10-11, mit T in K, x=T2-293.700, y=374,11-T, A=5,4266514, B=-2005,1, C=1,3869·10-4; D=1,1965·10-11,
E=-0,0044, F=-0,0057148) dargestellt werden.
Im System NaCl-H2O (Abb. 2) können bei Normaldruck die festen Phasen Eis, NaCl (Halit) und die
binäre Verbindung NaCl·2H2O (Hydrohalit) mit Lösung koexistieren. Ein eutektischer Punkt, an dem Hydrohalit, Eis, Lösung und Dampf koexistieren, liegt bei -20,8ºC. Die Löslichkeit von NaCl in H2O bei
0ºC liegt bei 26,3 Masse-%, bei einer Temperatur von 100ºC bei 28 Masse-%. Bei steigenden
Temperaturen steigt die Löslichkeit von NaCl, wie aus dem Verlauf der Dreiphasenlinie (NaCl,
NaCl-Lösung, H2O-Gasphase) ersichtlich wird. Ein Maximum der Löslichkeit von NaCl liegt am Schmelzpunkt des NaCl bei 800,4ºC.
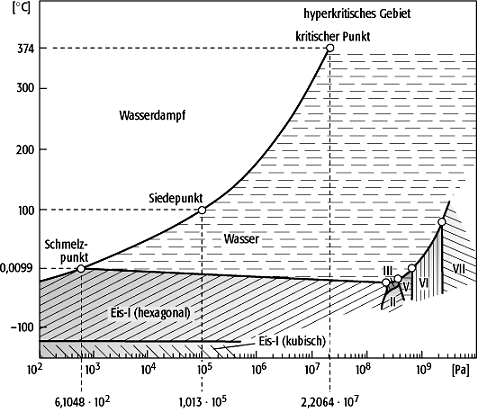 Phasendiagramm 1: semilogarithmisches Phasendiagramm für H2O. Phasendiagramm 1: semilogarithmisches Phasendiagramm für H2O.
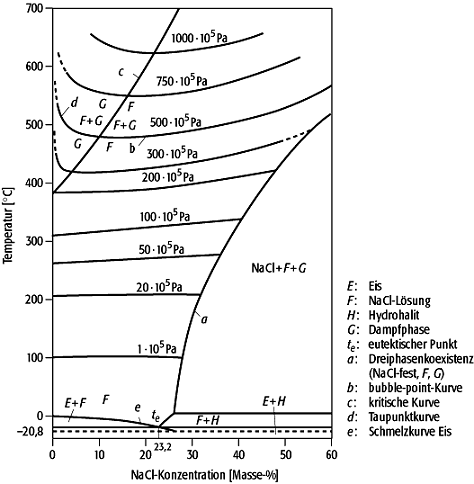 Phasendiagramm 2: Phasendiagramm des Systems NaCl-H2O. Phasendiagramm 2: Phasendiagramm des Systems NaCl-H2O. |
|