| |
kovalente Bindung, Kovalenzbindung, Atombindung, Elektronenpaarbindung, Bindung von Atomen durch gemeinsame Elektronenpaare. Nach der ursprünglich von Lewis entwickelten Theorie vermag ein Elektronenpaar, das zwei oder mehr Atomen gemeinsam angehört, eine Bindung zwischen diesen Atomen vermitteln. Rein schematisch kann man die bindenden Elektronen der Valenzschale jedem der Bindungspartner zurechnen, die dadurch beide formal eine (besonders stabile) Edelgaskonfiguration erlangen (Oktettregel). Die einzelnen Atome sind jeweils mit Ze -Z Elektronen an der Bindung beteiligt (Z = Ordnungszahl, Ze = Ordnungszahl des im Periodensystem folgenden Edelgases). Es können mehrere Elektronenpaare an einer einzigen Bindung beteiligt sein, man spricht dann von Doppel- bzw. Dreifachbindungen. In Strukturformeln symbolisiert man gemeinsame Elektronenpaare durch einen Strich, z.B. für H2: H-H (Einfachbindung), O2: O=O (Doppelbindung) und N2: N≡N (Dreifachbindung). Die Anzahl kovalenter Bindungen, die ein Atom im Einklang mit der Oktettregel eingehen kann, nennt man seine Bindigkeit,
Bindungszahl oder Wertigkeit.
Kovalente Bindungen sind gerichtet und nur zwischen den beteiligten Atomen wirksam. Häufig entstehen durch kovalente Bindung Moleküle, die aus einer begrenzten Anzahl von Atomen bestehen
und als individuelle Einheiten existieren können. Gelegentlich entstehen jedoch auch ein-, zwei- oder
dreidimensional vernetzte Strukturen wie beispielsweise Graphit (zweidimensionales Netzwerk) und
Diamant (dreidimensionales Netzwerk) (Abb.). KE
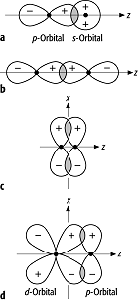 homöopolare Bindung: σ-Bindung: Überlappung (a) von s- und p-Orbital entlang der Rotationsachse des p-Oribitals und (b) zweier p-Orbitale entlang der gemeinsamen Längsachse zu einer σ-Bindung. Die maximale Überlappung beider Orbitale erfolgt auf der Bindungsachse. π-Bindung: Seitliche Überlappung (c) zweier p-Orbitale und (d) eines d- und p-Orbitals zu einer π-Bindung. Die maximale Überlappung der Orbitale erfolgt gleichermassen ober- und unterhalb der Bindungsachse. homöopolare Bindung: σ-Bindung: Überlappung (a) von s- und p-Orbital entlang der Rotationsachse des p-Oribitals und (b) zweier p-Orbitale entlang der gemeinsamen Längsachse zu einer σ-Bindung. Die maximale Überlappung beider Orbitale erfolgt auf der Bindungsachse. π-Bindung: Seitliche Überlappung (c) zweier p-Orbitale und (d) eines d- und p-Orbitals zu einer π-Bindung. Die maximale Überlappung der Orbitale erfolgt gleichermassen ober- und unterhalb der Bindungsachse. |
|