| |
gequantelte Zahlen, die den Zustand eines Elektrons in einem wasserstoffähnlichen Atom eindeutig beschreiben. Die Bewegung eines Elektrons in einem wasserstoffähnlichen Atom wird durch eine Wellenfunktion Ψ(x,y,z) beschrieben; |Ψ(x,y,z)|2 dV gibt die Wahrscheinlichkeit an, das Elektron im Volumenelement dV am Ort x,y,z zu finden. In Kugelkoordinaten r,θ,φ kann die Wellenfunktion eines Atomorbitals in ein Produkt dreier Funktionen separiert werden:
Ψ(r,θ,φ)=Rn,l(r)·Θl,m(θ)·Φm(φ).
4πr2Rn,l2(r)dr gibt die Wahrscheinlichkeit an, ein Elektron im Abstand r vom Atomkern zu finden; die Form und Orientierung der Atomorbitale wird durch Θ und Φ beschrieben. In Abhängigkeit von den Quantenzahlen n, l und m nehmen R, Θ und Φ verschiedene algebraische Formen an, die verschiedenen Energiezuständen des Elektrons entsprechen (Orbitale). Der Zustand eines Atoms wird durch die Angabe von vier Quantenzahlen für jedes seiner Elektronen charakterisiert (Elektronenkonfiguration), wobei nach dem Pauli-Prinzip jede Kombination von Quantenzahlen nur ein einziges Mal auftreten kann. a) Hauptquantenzahl: bezeichnet eine Elektronenschale im Sinne des Bohrschen Atommodells: 1 ≤ n≤∞. Eine Schale kann maximal 2n2 Elektronen aufnehmen. Anstelle der Hauptquantenzahl n verwendet man auch die Grossbuchstaben K, L, M, N, etc. für n=1,2,3,4,... und spricht von K-Schale, L-Schale, etc. b) Nebenquantenzahl: drückt das Bahnmoment:
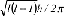 des Elektrons aus und bezeichnet eine Unterschale und die Art des dazugehörigen Orbitals. Zu jeder Hauptquantenzahl n gibt es n Unterschalen mit 0 ≤ l≤n-1. Diese Orbitale werden auch durch die Buchstaben s,p,d,f,g,... für l=0, 1,2,...,n-1 bezeichnet. Ein Elektron mit l=0 wird als s-Elektron, eines mit l=1 als p-Elektron, eines mit l=2 als d-Elektron etc. bezeichnet. c) magnetische Quantenzahl: bezeichnet jeweils 2l+1 verschiedene Atomorbitale innerhalb einer Unterschale mit -l ≤ m≤+l. d) Spinquantenzahl: bezeichnet den Elektronenspin: des Elektrons aus und bezeichnet eine Unterschale und die Art des dazugehörigen Orbitals. Zu jeder Hauptquantenzahl n gibt es n Unterschalen mit 0 ≤ l≤n-1. Diese Orbitale werden auch durch die Buchstaben s,p,d,f,g,... für l=0, 1,2,...,n-1 bezeichnet. Ein Elektron mit l=0 wird als s-Elektron, eines mit l=1 als p-Elektron, eines mit l=2 als d-Elektron etc. bezeichnet. c) magnetische Quantenzahl: bezeichnet jeweils 2l+1 verschiedene Atomorbitale innerhalb einer Unterschale mit -l ≤ m≤+l. d) Spinquantenzahl: bezeichnet den Elektronenspin:
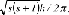 wobei s nur die beiden Werte s=±1/2 haben kann. Jedes Orbital wird mit maximal zwei Elektronen entgegengesetzten Spins besetzt (Pauli-Prinzip). wobei s nur die beiden Werte s=±1/2 haben kann. Jedes Orbital wird mit maximal zwei Elektronen entgegengesetzten Spins besetzt (Pauli-Prinzip). |
|